آب، در زندگی روزمره ما، عموما با فرمول H2O شناخته میشود؛ یک مولکول با دو اتم هیدروژن و یک اتم اکسیژن. اما در دنیای مهندسی هستهای و پژوهشهای علمی پیشرفته، ترکیب دیگری از آب وجود دارد که به دلیل ساختار اتمی خاص خود، نقشی حیاتی و استراتژیک ایفا میکند: آب سنگین. این ماده، که تنها از نظر یک نوترون اضافی با آب معمولی تفاوت دارد، خواص فیزیکی و شیمیایی متفاوتی را به نمایش میگذارد که آن را به یک عنصر کلیدی در فناوریهای حساس تبدیل کرده است. در این مقاله به طور جامع بررسی میکنیم که آب سنگین چیست، چه تفاوتی با آب معمولی دارد و چرا اینقدر ارزشمند است.
آب سنگین چیست؟
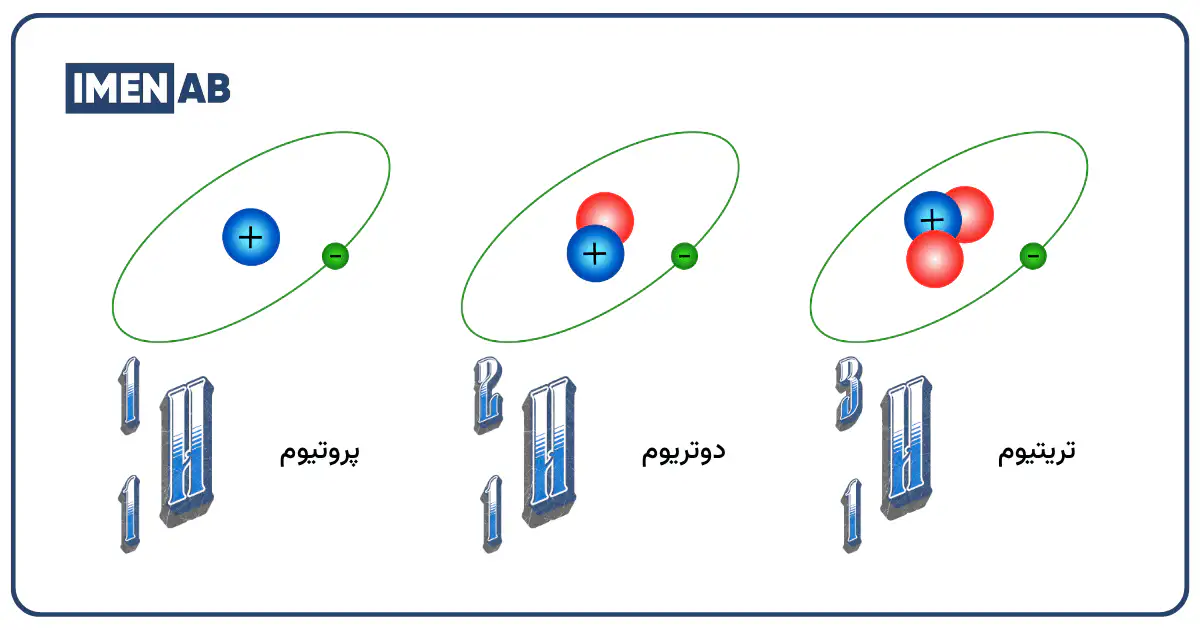
در پاسخ به سوال آب سنگین چیست؟ میتوان گفت آب سنگین یا D2O، آبی است که در آن اتمهای هیدروژن معمولی (پروتیوم) با دوتریوم جایگزین شدهاند. دوتریوم یک ایزوتوپ پایدار هیدروژن است که هسته آن برخلاف هیدروژن معمولی، علاوه بر یک پروتون، شامل یک نوترون نیز هست. این نوترون اضافی باعث میشود که مولکول آب سنگین، از نظر جرمی تقریباً ۱۰ درصد سنگینتر از آب معمولی باشد. آب سنگین به طور طبیعی و با غلظت بسیار کم (حدود یک مولکول در هر ۷۰۰۰ مولکول) در آبهای معمولی کره زمین یافت میشود.
زیربنای علمی: ساختار و تفاوتهای کلیدی آب سنگین و آب سبک
تفاوتهای آب سنگین و آب معمولی، از سطح زیراتمی آغاز شده و به خواص ماکروسکوپی آنها تسری مییابد. درک این تفاوتها برای فهم علت کاربرد خاص آب سنگین در مهندسی هستهای ضروری است. این بخش به شما نشان میدهد که چگونه یک تفاوت اتمی به ظاهر کوچک، منجر به خواصی کاملاً متمایز میشود و تأکید میکند که تفاوت آب سنگین و سبک دقیقاً در کجاست.
ایزوتوپ دوتریوم: راز سنگین بودن آب
راز سنگین بودن D2O در حضور دوتریوم (D) نهفته است. ایزوتوپها اتمهایی از یک عنصر هستند که تعداد نوترونهای متفاوتی دارند. در حالی که هسته هیدروژن سبک (پروتیوم) تنها یک پروتون دارد، هسته دوتریوم دارای یک پروتون و یک نوترون است؛ یعنی تقریباً دو برابر سنگینتر. این دوگانگی در جرم اتمی، تغییر چشمگیری در جرم مولکولی D2O ایجاد میکند. باید تأکید کرد که دوتریوم یک ایزوتوپ پایدار است و برخلاف تریتیوم (ایزوتوپ سوم هیدروژن)، آب سنگین غیررادیواکتیو است.
مقایسه فیزیکی آب سنگین و آب معمولی
جرم مولکولی بیشتر آب سنگین منجر به تغییرات فیزیکی قابل توجهی میشود که آن را از آب معمولی متمایز میسازد. از جمله این تفاوتها میتوان به نقطه جوش و انجماد اشاره کرد که در D2O اندکی بالاتر است. این خواص فیزیکی متفاوت، در فرآیندهای صنعتی و جداسازی آب سنگین اهمیت حیاتی پیدا میکنند.
| ویژگی فیزیکی | آب معمولی (H2O) | آب سنگین (D2O) |
| جرم مولکولی | ۱۸/۰۱۵ گرم بر مول | ۲۰/۰۲۷ گرم بر مول |
| نقطه انجماد | ۰ درجه سانتیگراد | ۳/۸۱ درجه سانتیگراد |
| نقطه جوش | ۱۰۰ درجه سانتیگراد | ۱۰۱/۴۲ درجه سانتیگراد |
| چگالی (در ۲۵ درجه سانتیگراد) | ۰/۹۹۷ گرم بر سانتیمتر مکعب | ۱/۱۰۴ گرم بر سانتیمتر مکعب |
یکی از جالبترین پیامدهای چگالی بیشتر آب سنگین این است که اگر یخ آب سنگین در آب معمولی قرار گیرد، برخلاف یخ آب معمولی، غرق میشود.
فراوانی طبیعی دوتریوم در آب معمولی تقریباً ۱۵۶ قسمت در میلیون (ppm) یا ۰.۰۱۵۶٪ است.
سازمان زمینشناسی آمریکا (USGS)
خواص شیمیایی و بیولوژیکی آب سنگین
پیوند قویتر دوتریوم با اکسیژن، به دلیل جرم بالاتر، تأثیر مستقیمی بر رفتار شیمیایی و بیولوژیکی آب سنگین دارد. این تأثیر که به عنوان «اثر ایزوتوپی جنبشی» شناخته میشود، سرعت واکنشها و پایداری مولکولهای آلی را تغییر میدهد.
خواص شیمیایی آب سنگین
به دلیل پیوندهای قویتر دوتریوم، آب سنگین در مقایسه با آب معمولی، در واکنشهای شیمیایی کندتر عمل میکند. این پدیده بر سرعت تبدیل و تجزیه مواد تأثیر میگذارد. پیوندهای هیدروژنی در D2O نیز قویتر هستند، که باعث میشود خواص ترمودینامیکی آن متفاوت باشد. این تفاوت در سرعت واکنشها باعث میشود که آب سنگین در برخی از آزمایشهای تحقیقاتی شیمیایی، مانند سنتز مولکولهای نشاندار شده یا مطالعات مکانیسم واکنش، ابزاری بینظیر باشد.
اثرات بیولوژیکی و زیستی آب سنگین
از نظر زیستی، آب سنگین در غلظتهای بالا سمی است، اگرچه نه به صورت رادیواکتیو، بلکه به دلیل اختلال در فرآیندهای حیاتی. حیات به دلیل ظرافت فرآیندهای بیوشیمیایی، به جرم بسیار سبک هیدروژن معمولی عادت کرده است. جایگزینی هیدروژن با دوتریوم سنگینتر میتواند آنزیمها، پروتئینها و فرآیندهای حیاتی مانند میتوز (تقسیم سلولی) را کند یا متوقف کند.
آب سنگین، در غلظتهای بالا، باعث کندی فرآیندهای زیستی میشود و میتواند حیات را متوقف کند؛ این به ما نشان میدهد که ظرافت حیات تا چه حد وابسته به جرم سبک هیدروژن است.
دکتر هارولد یوری، کاشف دوتریوم و برنده جایزه نوبل
آب سنگین چه کاربردی دارد؟
کاربردهای آب سنگین، حوزه هستهای و تحقیقات پزشکی را شامل میشود و نشان میدهد که چرا این ماده در بازار جهانی اینقدر گرانبها و تحت نظارت دقیق است.
کاربرد در رآکتورهای هستهای
مهمترین و استراتژیکترین کاربرد آب سنگین، در رآکتورهای هستهای با فشار آب سنگین (PHWR) است. در این رآکتورها، D2O دو نقش کلیدی دارد:
کندکننده نوترون (Moderator): آب سنگین به دلیل داشتن نوترونهای اضافی در دوتریوم، میتواند سرعت نوترونهای حاصل از شکافت اورانیوم را به طور مؤثری کند کند. این کندسازی برای ادامه واکنش زنجیرهای هستهای ضروری است.
خنککننده: علاوه بر کندسازی، در برخی طراحیها به عنوان خنککننده رآکتور نیز استفاده میشود.
مزیت بزرگ استفاده از آب سنگین این است که رآکتور میتواند از اورانیوم طبیعی (غنینشده) به عنوان سوخت استفاده کند، در حالی که رآکتورهای آب سبک (مثل PWR) نیازمند اورانیوم با درصد غنیسازی بالا هستند. این ویژگی، آب سنگین را به یک دارایی استراتژیک بینالمللی تبدیل کرده است.

کاربردهای علمی و پزشکی
فراتر از حوزه هستهای، آب سنگین کاربردهای ارزشمندی در تحقیقات پزشکی و شیمی دارد:
ردیاب متابولیک: در پزشکی، از D2O برای اندازهگیری سرعت سوختوساز، مصرف انرژی و تخمین ترکیب بدن (مانند درصد چربی) استفاده میشود. بیمار مقدار کمی آب سنگین مصرف میکند و سپس با اندازهگیری دوتریوم در مایعات بدن، فرآیندهای متابولیک ردیابی میشوند.
طیفسنجی NMR: آب سنگین یک حلال ضروری در طیفسنجی رزونانس مغناطیسی هستهای (NMR) است. دوتریوم دارای سیگنال NMR متفاوتی نسبت به هیدروژن معمولی است و بنابراین، آب سنگین به عنوان حلال، سیگنالهای هیدروژنهای مولکول مورد مطالعه را مختل نمیکند.
تولید ایزوتوپها: آب سنگین به طور غیرمستقیم در تولید ایزوتوپهای خاص مانند تریتیوم که در تحقیقات همجوشی هستهای اهمیت دارد، کاربرد دارد.
تولید، نظارت و ایمنی در فرآیند جداسازی آب سنگین
به دلیل اهمیت استراتژیک آب سنگین، تولید آن یک فرآیند پیچیده و پرهزینه است و تحت نظارت آژانس بینالمللی انرژی اتمی (IAEA) قرار دارد. همچنین، سؤالات زیادی در مورد ایمنی و اثرات مصرف آن بر سلامتی وجود دارد که باید با دقت به آنها پاسخ داد.
آب سنگین چگونه تولید میشود؟
آب سنگین در واقع تولید نمیشود، بلکه از آب معمولی جدا و خالصسازی میشود، چرا که دوتریوم به طور طبیعی در آبهای زمین وجود دارد. فرآیندهای صنعتی پیچیدهای برای جداسازی D2O به کار میروند که بر تفاوتهای فیزیکی و شیمیایی جزئی بین H2O و D2O تکیه دارند.
فرآیند سولفید گیردلِر (Girdler Sulfide Process): روش اصلی مورد استفاده، که بر مبنای تبادل ایزوتوپی بین آب و هیدروژن سولفید H2S در دماهای مختلف استوار است.
تقطیر و الکترولیز: از آنجایی که D2O نقطه جوش و انجماد بالاتری دارد، از تقطیر یا تجزیه الکتریکی آب نیز میتوان برای غنیسازی دوتریوم استفاده کرد، هرچند این روشها معمولاً کارایی کمتری دارند.
ایمنی مصرف و مسمومیت آب سنگین
آیا آب سنگین خوردنی است؟ بله، در مقادیر کم، آب سنگین بیخطر است. بدن انسان به طور طبیعی مقدار کمی D2O را در فرآیندهای متابولیک دفع میکند. اما اگر آب سنگین بنوشیم چه اتفاقی برای ما میافتد؟ اگر یک فرد مقدار کمی (مثلاً یک لیوان) بنوشد، هیچ عارضه سوئی مشاهده نخواهد شد. مشکل زمانی شروع میشود که درصد دوتریوم در مایعات بدن به طور قابل توجهی بالا رود. اثرات نامطلوب بر سلامتی از غلظتهای ۲۰ تا ۲۵ درصد شروع شده و در غلظتهای بالا میتواند کشنده باشد. دلیل اصلی عدم مصرف روزانه آب سنگین، هزینه گزاف و کاربرد استراتژیک آن است نه خطر مسمومیت فوری.
جمعبندی
در این مقاله، ما به قلب ساختار آب سنگین و کاربردهای منحصر به فرد آن پرداختیم. آموختیم که تفاوت در یک نوترون، چه خواص فیزیکی و شیمیایی متمایزی ایجاد میکند و چرا این ماده در فناوری هستهای و تحقیقات پزشکی تا این حد ارزشمند است. از کندکنندگی نوترونها در رآکتورها تا ردیابی متابولیسم در بدن انسان، D2O همچنان یک ماده حیاتی و کمیاب باقی میماند.
سوالات متداول
تحقیقات نشان میدهد که آب سنگین طعم کمی شیرینتر نسبت به آب معمولی دارد. این تفاوت در طعم به دلیل تغییر در خواص پیوند هیدروژنی و برهمکنش آن با گیرندههای چشایی انسان است، اما این تفاوت بسیار جزئی است و قابل تشخیص برای همه نیست.
آب سنگین به طور طبیعی در تمامی منابع آب یافت میشود؛ شامل اقیانوسها، رودخانهها، دریاچهها و حتی در بدن ما. با این حال، غلظت آن بسیار کم است، تقریباً ۰.۰۱۵ درصد از کل مولکولهای آب.
خیر. آب سنگین غیررادیواکتیو است. این ایزوتوپ هیدروژن، یعنی دوتریوم، یک ایزوتوپ پایدار است. تنها ایزوتوپ هیدروژن که رادیواکتیو است، تریتیوم است که نیمهعمر کوتاهی دارد و نباید با دوتریوم اشتباه گرفته شود.
در طول جنگ جهانی دوم، هدف اصلی قدرتهای بزرگ (به ویژه آلمان) از توسعه آب سنگین، استفاده از آن به عنوان کندکننده نوترون برای ساخت رآکتورهای هستهای بود که میتوانستند پلوتونیوم (یک ماده شکافتپذیر) برای ساخت بمب اتمی تولید کنند.







